Đề thi thử THPTQG 2016 môn Hóa – THPT Đồng Đậu lần 2 tổ chức thi thử cho học sinh khối 12, có đáp án chi tiết các em tham khảo bên dưới:
Đề thi thử THPTQG 2016 môn Hóa – THPT Đồng Đậu lần 2

















Đáp án đề thi thử THPTQG 2016 môn Hóa – THPT Đồng Đậu lần 2
Câu 1=>D
Câu 2: CuSO
khan dùng để nhận biết hơi nước ( chuyển từ màu trắng thành xanh lam)
Dd Ca(OH)
nhận biết CO
( kết tủa trắng) =>C
Câu 3 =>A
Câu 4:
X : 3s
; Y : 3s
; Z : 4s
( e lớp ngoài cùng )
=> X(IA) ; Y(IIA) cùng chu kỳ 3; Z(IA) chu kỳ 4
Cùng chu kỳ thì từ trái qua phải bán kính giảm dần
Cùng nhóm thì từ trên xuống dưới bán kính tăng dần
=>A
Câu 5: =>C
Câu 6: Dựa vào dãy điện hóa kim loại =>C
Câu 7: Este có công thức C
H
O
chỉ có thể là HCOOCH
có n = 0,15 mol
=> Phản ứng vừa đủ với NaOH tạo 0,15 mol HCOONa
=> m = 10,2g =>C
Câu 8: M
= 83.2 = 166g = 12x + y + 16z
Do este 2 chức nên z = 4 => 12x + y = 102
=> x = 8 ; y = 6
=>X là C
H
O
1 mol X phản ứng được với AgNO
/NH
tạo 4 mol Ag
=> Có thể X chứa 2 nhóm HCOO-.
Mà 1 mol X phản ứng đủ với 4 mol NaOH
=> Có thể X là este 2 chức của phenol
CT thỏa mãn : o,m,p-(HCOO)
C
H
=>C
Câu 9 =>A
Câu 10: (2) S ; (3) Ag
PO
; (4) AgCl =>D
Câu 11: Vì n
: n
= 1,8 : 1 = 1,8
=> Phản ứng tạo x mol muối NaH
PO
và y mol Na
HPO
=> n
= x + 2y = 1,8 và n
= x + y = 1
=> x = 0,2 mol ; y = 0,8 mol =>A
Câu 12: Glucozo -> 2C
H
OH + 2CO
=> n
= 0,2 mol => m = 9,2g
=> V
= (m
/d
). 100/90 = 12,78 ml =>B
Câu 13: CT : CH
CH
CH
NH
; (CH
)
CHNH
=>B
Câu 14: n
= 0,1 ; n
= 0,1 ; n
= 0,2
Do n
< 8/3.n
nên phản ứng chỉ tạo Fe
3Fe + 8H
+ 2NO
-> 3Fe
+ 2NO + 4H
O
=> Sau phản ứng còn lại : 0,1 – 0,075 = 0,025 mol
Fe + Cu
-> Fe
+ Cu
=> m = m
= 64.0,025 = 1,6g =>D
Câu 15:
+) Xét về M : X có M lớn nhất => t
sôi cao nhất
+) Với Y,Z,T có M tương đương. Xét khả năng tạo liên kết hidro liên phân tử :
Axit axetic > ancol etylic > dimetyl ete =>B
Câu 16
n
: n
= 1 : 2 => n
: n
= 1 : 4
Xét các cặp amin liên tiếp mà (H : C) 1 chất nhỏ hơn 4 ; 1 chất lớn hơn 4 thì thỏa mãn
=>C
Câu 17 =>D
Câu 18: Có thể xảy ra 2 trường hợp :
+) TH
: mỗi anken phản ứng tạo 1 ancol
+) TH
: có thể anken tạo 2 ancol nhưng trùng với ancol được tạo ra do anken còn lại và tổng các loại ancol vẫn là 2
Xét 4 đáp án chỉ có eten (tạo C
H
OH) và But-2-en (Tạo CH
CH(OH)C
H
)
Thỏa mãn =>B
Câu 19: =>A
Câu 20 : Có nhiều protein không tan trong nước như keratin (tóc) ….=>B
Câu 21: Do số mol các chất khí 2 vế bằng nhau => sự thay đổi áp suất không ảnh hưởng đến cân băng.
Chất xúc tác không làm chuyển dịch cân bằng mà chỉ làm cho cân bằng nhanh chóng được thiết lập
=>D
Câu 22: =>B
Câu 23: Các chất có cùng nồng độ nên phân tử nào phân ly được nhiều H
hơn sẽ có tính axit mạnh hơn => pH nhỏ hơn => pH
< pH
KNO
là muối trung hòa => pH > pH
Na
CO
là muối của axit yếu và bazo mạnh nên thủy phân tạo môi trường bazo
=> pH > pH
=>C
Câu 24: n
= 0,64125 mol ; m
+ m
= 31,68g
Bảo toàn khối lượng : m
+ m
= m
+ m
+ m
=> n
= 0,09 mol
Vì khi A + KOH tạo muối của Gly , Ala , Val đều là amino axit có 1 nhóm NH
; 1 nhóm COOH và no
Mặt khác : 0,045 mol A phản ứng đủ với 0,12 mol KOH => n
= n
= 0,12 mol
Xét 0,045 mol A : m
= 13,68.2/3 = 9,12g
Bảo toàn khối lượng : m
+ m
= m
+ m
( n
= n
= 0,045 mol = n
) => m
= 15,03g
=> m
= 5,085g => n
= 0,045 mol
=> m
+ m
= 127n
+ 155n
= 9,945g
Lại có : n
+ n
= n
– n
= 0,075 mol
=> n
= 0,015 ; n
= 0,06 mol
=> %m
= 50,70 % =>A
Câu 25: Cả 4 phát biểu đều đúng =>D
Câu 26: =>D
Câu 27: n
= n
=> 2n
= n
Mà n
: n
= 1 : 4
=> X là CH
O hay HCHO =>D
Câu 28: Xét ttongr quát : Khử
+ OXH
-> Khử
+ OXH
(1) => Tính oxi hóa của Br
mạnh hơn Fe
(2) => Cl
oxi hóa mạnh hơn Br
=> Cl
oxi hóa mạnh hơn Fe
=>D
Câu 29: Dựa vào 4 đáp án thấy chỉ có amino axit có 1 nhóm COOH và 1 nhóm NH
Có dạng H
NRCOOH + NaOH -> H
NRCOONa + H
O
Bảo toàn khối lượng : m
+ m
= m
+ m
Có n
= n
= n
=> n
.(40 – 18) = m
– m
=> n
= 0,05 mol
=>M
= 75g => H
NCH
COOH =>C
Câu 30: n
= 0,1 mol ; n
= 0,3 mol
Vì X + NaOH tạo 2 khí làm xanh quì tím ẩm
=> CT của X là : NH
OCOONH
CH
NH
OCOONH
CH
+ 2NaOH -> NH
+ CH
NH
+ Na
CO
+ 2H
O
=> chất rắn gồm 0,1 mol Na
CO
và 0,1 mol NaOH=> m = 14,6g =>C
Câu 31: Bảo toàn khối lượng : m
+ m
= m
=> n
= 0,26 mol
Khi oxit phản ứng với HCl thì cũng tương tự như 1 mol O bị thay thế bởi 2 mol Cl
=> n
= 2n
= 0,52 mol
=> m
+ m
= m
=> m + 0,52.35,5 = 3m + 1,82
=> m = 8,32g
m
= 9m + 4,06 = 78,94g
n
= n
= 0,52 mol => Giả sử có Ag => n
= 0,04 mol
Fe
+ Ag
-> Fe
+ Ag
=> n
= n
= 0,04 mol => n
= 0,04
Vậy trong 3,75m (g) hỗn hợp X ( 31,2g) sẽ có n
= 0,04.31,2/(8,32 + 4,16) = 0,1
Khi phản ứng với HNO
thì FeO -> Fe(NO
)
( Fe
-1e -> Fe
)
Xét 3,75m gam X : Ta thấy n
= n
= 1,3 mol
Khi phản ứng với HNO
thì n
= n
+ n
= n
= 1,4 mol
=> m’ = m
+ m
= 8,32.2,5 + 1,4.62 = 107,6g
( Nếu xét trường hợp không tạo NH
NO
) =>A
Câu 32 : Muối Y có thể tráng gương => HCOONa
Z hòa tan được Cu(OH)
điều kiện thường => có nhiều nhóm OH kề nhau
=> X là este của ancol đa chức và HCOOH
=> n
= n
= 0,1 mol => M
= 76g ( C
H
(OH)
)
=> X là HCOOCH
CH(CH
)OOCH =>B
Câu 33: n
= 0,05 mol ; n
= 0,1 mol ;
Lại có n
= 0,3 mol => 2n
> (2n
+ n
)
=> Na còn tác dụng với H
O
=> n
= 2( n
– ½ n
) = 0,4mol
=> Muối gồm : 0,05 mol Na
SO
; 0,1 mol NaCl ; 0,4 mol NaOH
=> m
= 28,95g =>B
Câu 34: n
= 0,2 mol ; n
= 0,1 mol
Giả sử phản ứng chỉ tạo Na
CO
=> m
= m
= 106.(1/2 .0,2 + 0,1) = 21,2g > m
=> Có x mol NaOH phản ứng
=> Chất rắn gồm (0,2 – x) mol NaOH và (0,1 + 0,5x) mol Na
CO
=> m
= 40.(0,2 – x) + 106.(0,1 + 0,5x) = 19,9g
=> x = 0,1 mol
=> n
= ½ n
= 0,05 mol => V = 1,12 lit =>B
Câu 35: n
= n
= 1,35 mol
,m
= m
– (m
+ m
)
=> n
= 0,95 mol
A + Na dư => 2n
= n
+ n
=> n
=0,1 mol
A + NaOH dư :
+) Nếu Este của phenol => 2n
+ n
= n
=> n
= 0,1 mol và Este có dạng : RCOOC
H
R’ => số C
≥ 7
Vì số mol CO
lẻ . Số C trong mỗi chất > 1 => số C trong ancol phải là số lẻ và > 1
=> Số C
≥ 3
=> n
+ n
≥ 1,15 mol
=> số C trong axit = 2 và số C trong ancol = 3 ; este là HCOOC
H
Bảo toàn H : n
+ n
= 2n
– n
= 1,3 mol
=> H
+ H
= 13
Mà Số C trong ancol = 3 => số H ≤ 8
Số C trong axit = 2 => số H ≤ 4
=> Loại
+) Nếu este không phải của phenol => n
+ n
= n
=> n
= 0,2 mol
Xét cả 3 chất trong hỗn hợp A ta có thể gộp 3 chất lại thành : C
H
O
=> C
H
O
=> số pi = 9 => Số pi phản ứng với Brom = 9 – 2 = 7
=> n
= n
+ n
+ n
= 0,15.a + 0,1.b + 0,1.c
Có a + b + c = 7 => 0,7 < n
< 1,05
Chỉ có giá trị 0,75 mol thỏa mãn =>A
Câu 36:
4Fe(OH)
+ O
+ 2H
O -> 4Fe(OH)
2Fe(OH)
-> Fe
O
+ 3H
O
=>D
Câu 37: 2Fe + 6H
SO
-> Fe
(SO
)
+ 3SO
+ 6H
O =>A
Câu 38: Gọi thể tich cần tìm là V lit
,n
= n
=> n
+ 2n
= n
+ 2n
=> 0,1V + 2.0,05V = 0,1 + 2.0,15
=> V = 2 lit =>D
Câu 39: Khi cho từ từ NaOH vào AlCl
lúc đầu AlCl
rất dư nên tạo kết tủa trắng keo. Sau đó NaOH dư thì hòa tan kết tủa đó =>B
Câu 40: Câu hình e : 1s
2s
2p
3s
3p
3d
4s
Do e cuối điền vào phân lớp d => nhóm B
Tổng e
+ e
= 8 => nhóm VIIIB =>A
Câu 41: Tham gia phản ứng tráng bạc phải có nhóm CHO =>C
Câu 42: =>A
Câu 43
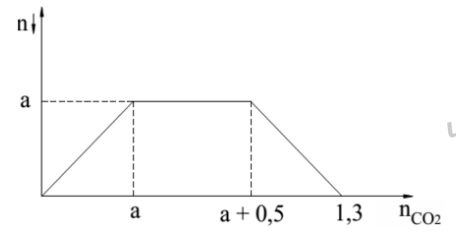
Dựa vào đồ thị :
(1) Đoạn đi lên : Ba(OH)
+ CO
-> BaCO
+ H
O
(2) Đoạn ngang : 2NaOH + CO
-> Na
CO
+ H
O
Na
CO
+ CO
+ H
O -> 2NaHCO
(3) Đoạn đi xuống : BaCO
+ CO
+ H
O -> Ba(HCO
)
Xét (2) => n
= n
= 0,5 mol => m = 20g
,Tổng số mol CO
phản ứng là 1,3 mol = n
+ 2n
=> n
= 0,4 mol = a
=> a + m = 20,4 =>C
Câu 44: =>A
Câu 45:Ta có : n
= n
= 0,15 mol
Để lượng HNO
phản ứng ít nhất thì Fe -> Fe
; Cu -> Cu
=> Bảo toàn e : 2n
+ 2n
= 3n
=> n
= 0,2 mol
=> n
= 4n
= 0,8 mol => C
= 0,8 lit =>C
Câu 46: =>A
Câu 47: =>B
Câu 48: Giả sử X có 3 mol C
H
và 2 mol C
H
Khi phản ứng với H
O tạo thành 3 mol C
H
OH ; x mol n-C
H
OH và (2 – x) mol i-C
H
OH
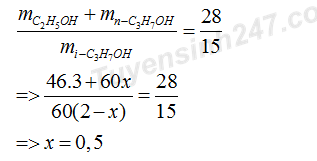
=> Trong Y có 1,5 mol i-C
H
OH =>%m
= 34,88% =>C
Câu 49 =>B
Câu 50: ta có : n
= 2n
= 2.0,05 = 0,1 mol
Nếu đốt cháy hết X bằng oxi thu được hỗn hợp oxit Z thì n
= ¼ n
= 0,025 mol
=> m
= m
+ m
= 22,7g = m
+ m
Lại có n
= n
= 0,12 mol => n
= 0,07 mol
=> Y có : 0,12 mol Ba(OH)
; 0,14 mol NaOH => n
= 0,38 mol
,n
= 0,05 mol => n
= 0,1 mol
=> n
= 4n
– n
= 0,02 mol
=> Kết tủa gồm 0,02 mol Al(OH)
; 0,12 mol BaSO
=> m = 29,52g =>B
Tất cả nội dung bài viết. Các em hãy xem thêm và tải file chi tiết tại đây:Download